

自新型冠状病毒引起的疫情暴发以来,科学家们一直在努力寻找有效的病毒抑制剂。当地时间3月20日,顶级学术期刊《科学》在线发表了一篇题为“Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors”的研究报告,科学家们用X射线以1.75埃分辨率解析了新冠病毒Mpro的晶体结构。新冠病毒中的主要蛋白酶(Mpro,又称为3CLpro)是一个重要的潜在药物靶标,对抑制病毒的复制至关重要。
此外,该研究探讨了一种α-酮酰胺抑制剂的作用。通过优化结构,研究人员将先导化合物开发成为SARS-CoV-2 Mpro的有效抑制剂。优化抑制剂的药代动力学特征显示出明显的肺向性,并且适用于通过吸入途径给药。
由于尚无具有类似裂解特异性的人蛋白酶,该抑制剂不太可能具有毒性。在新冠病毒仍在全球肆虐的当下,该研究有利于推动相关抑制剂的设计,促进治疗方法的形成。
该文章的作者主要由德国科研团队组成,包括德国吕贝克大学、德国汉诺威医学院、柏林大学附属夏里特医院、马尔堡大学、赫尔姆霍兹感染研究中心、中国长春吉大天元化学技术股份有限公司等,通讯作者为德国吕贝克大学生物化学研究所Rolf Hilgenfeld。
结构生物学家Rolf Hilgenfeld团队自2002-2003年严重急性呼吸系统综合征(SARS)暴发以来,就一直在尝试开发治疗冠状病毒的方法。当前,Hilgenfeld希望对新型冠状病毒感染的动物进行两种抑制剂化合物的测试,以期尽快开发出针对未来冠状病毒暴发的治疗方法。
新冠病毒是一种单链RNA正链包膜乙型冠状病毒。与引起SARS(严重急性呼吸系统综合症)和MERS(中东呼吸系统综合症)的另两种冠状病毒类似,它的基因组编码为非结构蛋白、结构蛋白和辅助蛋白。
非结构蛋白包括3-胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease,3CLpro)、木瓜蛋白酶样蛋白酶(papain-like protease)、解旋酶(helicase)、和RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)。结构蛋白则包括刺突糖蛋白(spike glycoprotein)。
冠状病毒中最具特征的药物靶标之一是上述的3-胰凝乳蛋白酶样蛋白酶,即主要蛋白酶(Mpro,也称为3CLpro)。与木瓜蛋白酶一样,这种酶在大型多蛋白1ab上的不少于11个切割位点上运行,对于加工从病毒RNA翻译的多蛋白是必不可少的,因此,抑制这种酶的活性将阻止病毒复制。
此前,研究人员已经设计并合成了拟肽α-酮酰胺,作为β冠状病毒和α冠状病毒的主要蛋白酶以及肠病毒的3CLpro的广谱抑制剂。
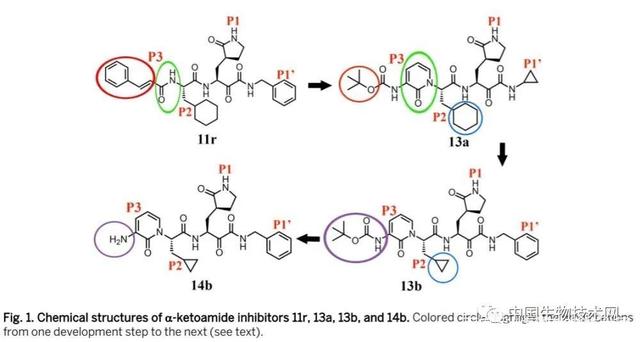
几种α-酮酰胺抑制剂的化学结构,11r为绿色圆圈,13a为红色圆圈,13b为蓝色圆圈
上述抑制剂化合物对MERS-CoV中东呼吸系统综合征冠状病毒、SARS-CoV(严重急性呼吸系统综合征冠状病毒)和肠道病毒均具有抗病毒作用,但其活性似乎在很大程度上取决于实验中使用的细胞类型。
为了优化它以延长化合物在血浆中的半衰期,研究人员将P3-P2酰胺键隐藏在吡啶酮环中,修饰了现有的化合物11r,以期这能够阻止细胞蛋白酶接近该键并使其裂解。
此外,为增加化合物在血浆中的溶解度并减少其与血浆蛋白的结合阻力,研究人员用疏水性稍差的Boc基团代替了疏水的肉桂酰基部分,得到13a这种化合物。
为了检查13a中引入的吡啶酮环是否与靶标的三维结构兼容,研究人员确定了SARS-CoV-2主要蛋白酶的晶体结构(分辨率为1.75)。
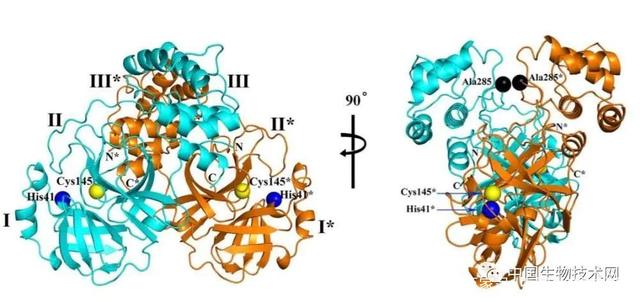
两种不同视图下SARS-CoV-2 主要蛋白酶的三维结构
研究人员发现,新冠病毒主要蛋白酶的三维结构与SARS-CoV主要蛋白酶的三维结构高度相似,序列同一性达96%。
其中,胰凝乳蛋白酶和小核糖核酸病毒3C蛋白酶样结构域I和II形成六链反平行β桶,在它们之间带有底物结合位点。结构域III是五个螺旋的球形簇,主要通过2个前体间盐桥相互作用参与调节Mpro的二聚化。
SARS-CoV-2的Mpro形成的紧密二聚体具有一个接触界面,主要位于分子A的结构域II与分子B的NH2末端残之间。
研究人员使用蛋白酶的晶体结构来对接α-酮酰胺抑制剂13a。他们发现,与11r相比,13a在小鼠中的血浆半衰期增加了约3倍(从0.3小时到1.0小时),体外动力学血浆溶解度提高了约19倍,同时热动力学溶解度提高了约13倍。但是,与11r相比,结构的调整导致其对SARS-CoV-2主要蛋白酶和肠病毒3C蛋白酶的抑制活性有所减少。
事实上,包括新冠病毒在内的β冠状病毒Mpro的S2口袋具有显著的可塑性,使其能够“狡猾”地适应较小抑制剂的形状。因此为了增强针对进化枝b的β冠状病毒的抗病毒活性,研究人员牺牲了抑制剂广谱活性的目标,用较小的环丙基取代了13a的P2环己基部分,得到化合物13b。
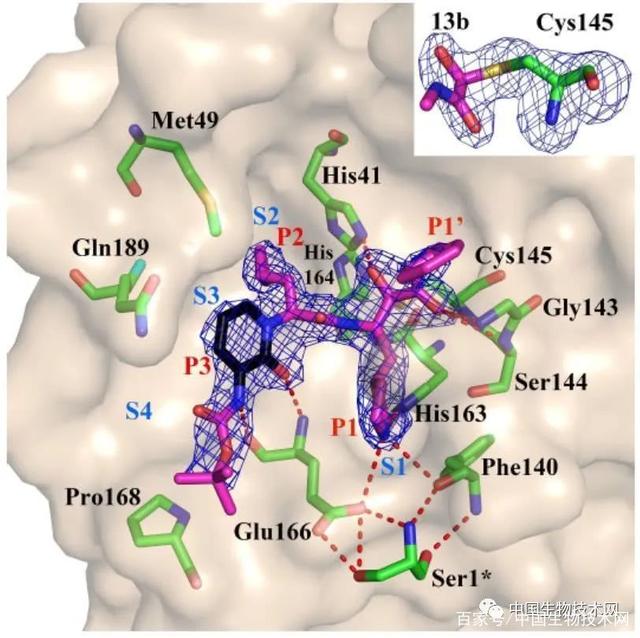
α-酮酰胺13b与SARS-CoV-2的Mpro的复合物X射线晶体结构,两种分辨率分别为1.95 和2.20
研究人员使用20 mg / kg的剂量对小鼠进行皮下途径的药代动力学研究发现,化合物13a在小鼠血浆中的平均停留时间为约1.6小时,停留时间最多为约4小时,通过尿液排出的时间最多为24小时。血管外给药后药物在血浆中的最高浓度值(峰浓度,Cmax)为334.5ng/mL。
尽管13a从血浆中消失的速度非常快,但24小时后它在肺中的浓度为135ng/g,在小鼠支气管肺泡灌洗液(BALF)中的浓度为52.7ng/mL,这表明它已经被组织吸收。
接下来,研究人员对13b的有效性进行了测试,他们发现,13b与人血浆蛋白的结合度达到90%。
同样对小鼠进行皮下注射时,研究人员用了更少的剂量(3 mg/kg),发现13b的Cmax为126.2 ng / mL,这大约是13a的峰浓度值的37%,但所用的化合物剂量大约降低了7倍。
同时,13b在血浆中的平均停留时间延长至2.7小时,半衰期约为1.8小时。与13a相比,13b在血浆中的清除速度较慢。
研究人员发现,4小时后,13b在小鼠肺组织中浓度仍达到约13ng/g。由于新冠病毒疾病对肺部有较大影响,13a和13b体现出的这种肺向性是有益的。
除皮下给药外,研究人员还使用吸入装置以3mg/kg对小鼠进行了雾化13b给药。24小时后,小鼠肺组织中存在13b的浓度为33ng/g。
小鼠对于抑制剂的吸入耐受良好,未显示任何不良反应,研究者们认为这表明将该化合物直接施用于肺部是可能的。
作者们最后写道,鉴于这些有利的药代动力学结果,此次研究为含吡啶酮的抗冠状病毒药物研发提供了有用的框架。